| Forside Søgning Brugsanvisning |
| Ind til listen: |
John Dalton
1. Daltons undersøgelser af damptrykJohn Dalton er mest berømt for sin grundlæggelse af teorien om atomer. Det skriver vi om nedenfor. Her beskriver vi hans vigtige arbejder om damptryk. Disse arbejder, var forudsætning for Daltons teori om atomer. der Man kan godt sige, at de er en fortsættelse af Watts arbejder i forbindelse med hans konstruktion af dampmaskiner, der er link for oven.
|
På billedet til højre viser det apparat, som blev brugt til undersøgelser af damptryk af både Watt og Dalton. Der er to lodrette rør, lukkede for oven og åbne for neden. Åbningen befinder nede i en beholder med kviksølv,
læs nærmere om det i vores artikel om Torricelli. Til venstre er der lufttomt i området B for oven, og længden af kviksølvsøjlen, regnet fra overfladen i C er den aktuelle barometerstand, ca 76 cm, man
siger, at atmodfærens tryk er 76 cmHg.
Til højre står der et lignende barometer, hvis øverste del er omgivet af et glasrør, der sidder fast på barometret ved hjælp af en vandtæt ring af kork ved det nederste A. Ved det øverste A sidder der en
lignende ring af kork, som der er nogle lodrette huller i, så der kan løbe vand forbi den ring. Forsøget startede nu med, at Dalton hældte varmt vand med kendt temperatur ned i røret ovenfra. Så sker der ingenting,
hulrummet for oven er jo lufttomt.
Så tog Dalton en pippette, sådan en: |  |
Dalton sluttede af dette forsøg, at når en væske opvarmes, så går den i kog, når dens damptryk når omgivelsernes tryk. Dette forklarer en iagttagelse, som Robert Boyle gjode mere end 100 år tidligere: Boyle stillede en skål med lunkent vand ind i et rum, som han kunne pumpe luft ud af med sin forbedrede sugepumpe. Han iagttog da, at vandet begyndte at koge, når trykket blev lavt nok.
 |
Hvis damp er umættet, går det helt anderledes. Dalton brugte Torricellis barometer til at undersøge, hvordan det forholder sig med umættede dampe. Billedet til venstre viser det samme rør i to forskellige situationer. Vi tænker os, at lufttrykket er 76 cmHg. Længst til venstre vises røret med en smule umættet damp for oven. Kviksølvsøjlens højde er 74 cm, så damptrykket er lille, kun 2 cmHg. Det er ikke urimeligt for et damptryk. Det skal være sådan, at der stadig er plads til, at mere vand kan fordampe. Til højre viser vi hvordan situationen er ændret når røret er skubbet lidt længere ned i skålen B. Trykket lige under niveauet af overfladen af kviksølvet i skålen er 76 cmHg. For hver cm man går op i røret falder trykket 1 cmHg. Højdeforskellen mellem kviksølvoverfladerne i de to rør er ca 2 cm. Derfor er trykket i luften til højre ca. 2 cmHg større end trykket i luften til venstre, altså 4 cmHg, dvs det dobbelte af trykket til venstre. Det er let at måle, at rumfanget til højre er halvt så stort som rumfanget til venstre. Produktet af tryk og rumfang er alså det samme i de to situationer. I dette tilfælde gælder Boyle-Mariottes lov altså. |
Vores kilde til ovenstående er omtalen hos LaCour og Appel, der stammer billedet også fra. Men LaCour og Appel omtaler ikke de talværdier, som jeg her har anvendt. Det hænger nok sammen med, at man burde udføre forsøget ved en højere temperatur, så damptrykket ikke er så lille.
 |
På billedet til venstre viser vi hvordan Dalton målte trykket i vanddamp, hvis temperatur er 100°C. Man starter med situationen A. Der er lidt kviksølv i røret, og oven over kviksølvet
til højre er der lidt vand og vanddamp, men ingen luft. Så flytter man røret over i kolben til venstre, hvor der er kogende vand. Når rørets temperatur er blevet 100°C ser man,
at de to kviksølvoverflader står i samme højde. Vanddampens tryk er altså 1 atm. dvs. 76 cmHg. Det er ikke overraskende.
På billedet til højre undersøger vi, om is også har et damptryk. I skålen øverst til højre er der en blanding af is og salt. Det sænker temperaturen under 0°. Det kan man se på termometret. I den nedadbøjede del af røret er der lidt vand, som er frosset til is, men ingen luft. Så trykket inde i røret til højre er isens damptryk. Højdeforskellen mellem de to kviksølvoverflader er et mål for isens damptryk i cmHg. | 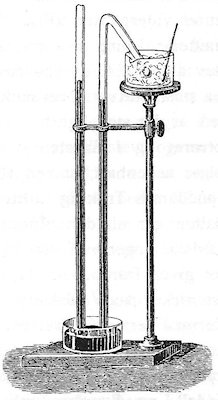 |
At is kan fordampe var velkendt hos husmødre i gamle dage; de vidste jo godt, at man kan tørre vasketøj ude i frostvejr!
|
Dalton fortsatte sine forsøg med apparaterne ovenfor med at undersøge damptryk for 6 andre væsker end vand. De opførte sig alle på samme måde som vand. Når man isolerer noget damp fra en af væskerne,
gælder Boyle-Mariottes lov med mindre trykket bliver så stort, at dampen begynder at fortætte sig. Det passer nu ikke helt, det kan man forstå hvis man tænker sig, at dampen er indesluttet under et
stempel, som vist til højre. Når man trykker stemplet nedad øges trykket under stemplet, men dampen bliver også varmere, og når det sker, gælder Boyle-Mariottes lov ikke. Dette faktum tog Daltons elev Joule
hensyn til, da han bestemte varmes mekaniske ækvivalent, der er link for oven.
Dalton gjorde en epokegørnde opdagelse, da han med pippetten sendte lidt almindelig luft op i Torricellis rør. Når han så sendte lidt vand derop, fordampede der lige så meget vand, som da det ikke var luft deroppe! Det var en stor overraskelse, også for andre af tidens fysikere. Overraskelsen skyldtes, at man skulle tro, at det var vanskeligere for vandet at fordampe, når der var luft i rummet, end det var, da der var lufttomt. |  |
2. Daltons atomteori
Begrebet atom har været kendt siden græsk oldtid. Der har indimellem været spekuleret på, om der er rigtigt, at stof består af små udelelige partikler, men Dalton var den første, der baserede sine overvejelser på iagttagelser. Ordet "atom" er afledt af det græske ord "atomos", der betyder "udelelig". Daltons atomer svarer til det, som vi i dag kalder molekyler.
Dalton opdagede, at når man stiller en skål med vand ind i et lukket rum, så fordamper der lige så meget vand når rummet er fyldt med luft, som der gør, hvis rummet er lufttomt. Tænk lige over det: Når man skal have noget ind i et rum, så bliver det da sværere og sværere at få det derind, jo mere der er derinde i forvejen. Daltons opdagelse var meget overraskende!
Nu går jeg over til at beskrive, hvordan jeg tror Dalton tænkte, da han gjorde sin overraskende iagttagelse, og da han formulerede Daltons lov:
|  |
Under processen sker det naturligvis, at et af vandatomerne oppe i luften går ned i vandet, og bliver der. Det sker hyppigere og hyppigere jo flere vandatomer, der er oppe i luften, og til sidst indstiller der sig en ligevægt. Man siger, at vanddampen oppe i luften er mættet.
Sådan forestiller jeg mig at Dalton har tænkt. Nu går jeg over til at fortælle lidt om det han offentliggjorde. Hovedpointerne er:
- Ethvert grundstof består af meget små partikler, der kaldes atomer.
- Atomerne i et bestemt grundstof er lige store, lige tunge og ens på andre måder; atomerne i to forskellige grundstoffer har forskellig vægt, forskellig størrelse og de er forskellige på andre måder.
- Atomer kan ikke deles, de kan ikke skabes og de kan ikke forsvinde.
- Atomer af forskellige grundstoffer kan forbindes med hinanden i simple antalsforhold og dermed skabe kemiske forbindelser.
- I kemiske reaktioner kan atomer hægtes sammen, sammensatte atomer kan adskilles og de kan arrangeres på nye måder.
Selv om man senere har fundet ud af små afvigelser fra disse udsagn, f.eks. atomspaltning, så er de stort set korrekte, og de danner et godt udgangspunkt for kemiens videre udvikling.
Dalton skrev et omfattende værk på 560 sider. Han offentliggjorde det i 1808. Titlen er "A New system of Chemical Philosophy. Siderne 218 og 219 ser sådan ud:
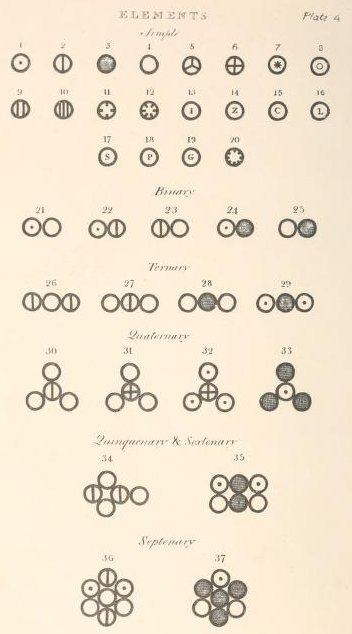

Øverst på side 219 er der en liste over 20 grundstoffer. 2 azote betyder kvælstof, også kaldet nitrogen, 8 lime betyder calcium, 9 soda betyder natrium, 10 potash betyder kalium, 11 strontites betyder strontium og 12 barytes betyder barium. Øverst på side 218 vises symboler for disse grundstoffer.
Derefter kommer der en liste over kemiske forbindelser. Det er stort set korrekt hvad angår hvilke grundstoffer, der er i de omtalte kemiske forbindelser. Men antallet af atomer, der indgår i de enkelte molekyler, er gætterier og normalt forkerte. F.eks beskrives vand som HO, ikke som H2O.
I omtalen af vand står der, at det enkelte vandmolekyle er omgivet af en fælles atmosfære af varme. Det tyder på, at Dalton ikke vidste, at varme er en form for bevægelse, sådan som det i 1798 blev beskrevet af Grev Rumford, der er link for oven.
3. Daltons lov
I 1793 skrev Dalton en bog om meteorologi. I denne bog skrev han, at i en blanding af luftarter vil hver enkelt luftart bidrage til det samlede tryk med en størrelse, der er uafhængigt af hvilke andre luftarter, der er i blandingen. Denne lov kaldes Daltons Lov. (I faglitteraturen kaldes luftarter for gasser, men for mig er gas noget mine bedstemødre brugte, når de skulle varme mad.) Daltons påstand var kontroversiel for sin tid, jeg tror at Dalton fik ideen til loven ved at tænke som i den indrammede tekst ovenfor. Ilt og brint er to luftater der meget let går i forbindelse med hinanden. Hvis man f.eks. har brint i en beholder med en lille åbning, så kan man holde et tændstik hen til åbningen. Så opstår der en flamme, og i den forener brinten sig med luftens ilt og danner vanddamp. Men man kan roligt blande lidt ilt og brint i en beholder ved stuetemperatur. Ilt- og brintatomerne støder som nævnt ikke sammen. Dalton kendte ikke betingelsen for, at der sker en forbrænding i beholderen, så der dannes vanddamp.
Dalton foreslog i 1803, at de små partikler i to luftarter måtte have vægte, der står i et simpelt forhold til hinanden. I dag ved vi, at det er rigtigt, fordi hvert atom er opbygget af lige tunge protoner og neutroner, så man må sige, at Dalton var meget tidligt på den med at sige noget om atomkernens opbygning!
Da denne hjemmeside handler om fysik, men ikke om kemi, standser vi her med beskrivelsen af Daltons arbejder med kemi.
| Hvis du støder på et ord, hvis betydning du ikke kender, så søg på ordet. |
 , fyldte den med vand, og stak spidsen af pippetten ned i kviksølvet og ind under rørets åbning. Så trykkede han på pippetten, og der boblede en lille smule
vand op gennem kviksølvet. Dalton sørgede for, at der kom så meget vand ind i røret, at det ikke fordampede alt sammen, men at der blev en lille bitte smule vand tilbage, oven på kviksølvet. Når der ikke
fordampede mere, kalder man dampen for mættet. Hvis kviksølvsøjlen til venstre ender h cm højere oppe end søjlen til venstre, så er trykket af mættet damp, ved den valgte temperatur, h cmHg.
Dalton trykkede nu røret til højre lidt længere ned i beholderen C. Det viste sig så, at kviksølvhøjden i forhold til overfladen i C var uforandret. Trykket i hulrummet for oven er altså uforandret, selv om
rumfanget er blevet mindre. Det, der er sket, er at en del af dampen er fortættet til vand. Mættede dampe kan altså ikke, i modsætning til luft, få større tryk når rumfanget formindskes.
, fyldte den med vand, og stak spidsen af pippetten ned i kviksølvet og ind under rørets åbning. Så trykkede han på pippetten, og der boblede en lille smule
vand op gennem kviksølvet. Dalton sørgede for, at der kom så meget vand ind i røret, at det ikke fordampede alt sammen, men at der blev en lille bitte smule vand tilbage, oven på kviksølvet. Når der ikke
fordampede mere, kalder man dampen for mættet. Hvis kviksølvsøjlen til venstre ender h cm højere oppe end søjlen til venstre, så er trykket af mættet damp, ved den valgte temperatur, h cmHg.
Dalton trykkede nu røret til højre lidt længere ned i beholderen C. Det viste sig så, at kviksølvhøjden i forhold til overfladen i C var uforandret. Trykket i hulrummet for oven er altså uforandret, selv om
rumfanget er blevet mindre. Det, der er sket, er at en del af dampen er fortættet til vand. Mættede dampe kan altså ikke, i modsætning til luft, få større tryk når rumfanget formindskes.